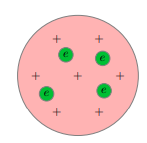
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом. Модель ТомсонаПервую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом». Согласно Томсону атом представляет собой шар размером порядка 10−8 см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1).
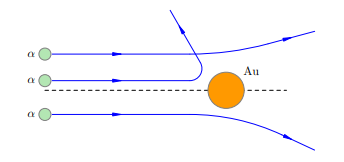
Рис.1.Модель атома Томсона Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален. Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, были подобраны формулы, хорошо описывающие спектр излучения атома водорода, но эти формулы из модели Томсона никак не следовали. Опыты РезерфордаВерна ли модель Томсона? Как в действительности распределены положительные и отрицательные заряды внутри атома? Чтобы ответить на эти вопросы, нужен был эксперимент, позволяющий проникнуть внутрь атома. Ученик Томсона, знаменитый английский физик Эрнест Резерфорд предложил с этой целью бомбардировать атом высокоэнергетичными α-частицами и смотреть, как они будут отклоняться положительным зарядом атома. Что такое α-частицы? Потоки этих частиц — так называемые «альфа-лучи» — были обнаружены при радиоактивном распаде некоторых элементов (например, радия). В результате тщательных исследований, проведённых опять-таки Резерфордом, было установлено, что каждая α-частица имеет положительный заряд, равный по модулю удвоенному заряду электрона, и массу, превышающую массу электрона примерно в 8000 раз. То есть, α-частица оказалась полностью ионизованным (лишённым электронов) атомом гелия. Резерфорд говорил об α-частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия. Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов! Энергия α-частиц очень велика — достаточно сказать, что скорость их вылета из радиоактивного образца составляет примерно 1/15 скорости света. Поэтому интересно было выяснить, на какие углы будут отклоняться столь мощные «снаряды» при рассеянии на отдельных атомах, а точнее — на их положительных зарядах. Пучок α-частиц направлялся на тончайшую золотую фольгу. Как гласит история, Резерфорд не сомневался в том, что углы отклонения должны быть весьма малы: имея столь огромную энергию, α-частицы должны проходить сквозь фольгу как нож сквозь масло. Только «для очистки совести», на всякий случай, он попросил учеников посмотреть, не возникает ли рассеяния α-частиц на большие углы. Каково же было всеобщее удивление, когда такие частицы обнаружились! Действительно, как и следовало ожидать, подавляющая доля α-частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший 90◦ (рис. 2).
Рисунок 2. Рассеяние α-частиц на атомах Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад. А «бумагой» в образном сравнении Резерфорда служил атом, устроенный согласно модели Томсона. Действительно, допустим, что положительный заряд атома q «размазан» по всему атому, то есть шару радиусом R ∼ 10−8 см. Этот положительный заряд создаёт электрическое поле, тормозящее и отклоняющее α-частицы. Вблизи атома потенциал данного поля: �∼���φ∼Rkq Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить α-частицу и отбросить её назад! Вычисления, проведённые Резерфордом, дали следующий результат: �∼10−13см.r∼10−13см. | |
| Просмотров: 150 | |