Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
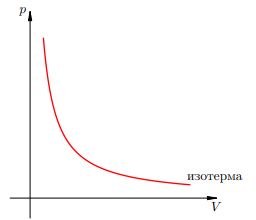
График изотермического процесса называется изотермой. Изотерма на pV -диаграмме — это график обратно пропорциональной зависимости �=������p=Vconst. Такой график является гиперболой. Изотерма-гипербола изображена на рис 1.
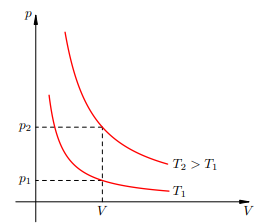
Изотерма на pV -диаграмме Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на pV -диаграмме. В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2.8). Первый процесс идёт при температуре �1T1, второй — при температуре �2T2.
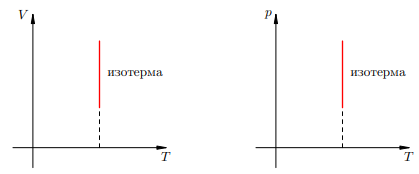
Чем выше температура, тем выше изотерма Фиксируем некоторое значение объёма V. На первой изотерме ему отвечает давление p1, на второй — p2 > p1. Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, T2 > T1. В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси T
Рисунок 2. Изотермы на V T- и pT-диаграммах | |
| Просмотров: 230 | |