Изменение энтропии в изопроцессах и в фазовых переходахЭнтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной. Если система совершает равновесный переход из одного состояния в другое, то изменение энтропии: Δ�1→2=�2−�1=∫12���=∫12��+���(1)ΔS1→2=S2−S1=∫12TδQ=∫12TdU+δA(1) Таким образом, по формуле (1) можно определить энтропию лишь с точностью до произвольной постоянной, т. е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий.
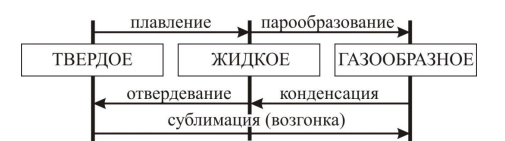
Отметим, что в последнем случае адиабатический процесс называют изоэнтропийным процессом, т. к. S=const. Поведение энтропии в процессах изменения агрегатного состоянияРассмотрим три агрегатных состояния: твердое, жидкое и газообразное и два перехода к ним (рис. 1).
Рис. 1. Схема возможных изменений агрегатного состояния вещества Фазовый переход «твердое тело–жидкость»Закон плавления и конденсации можно записать так: ��=±���δQ=±λdm. Проследим за поведением энтропии при этом фазовом переходе: Δ�=±��/�плΔS=±λm/Tпл Из этой формулы следует, что при плавлении энтропия возрастает, а при кристаллизации – уменьшается. Физический смысл этого результата достаточно ясен: фазовая область молекулы в твердом теле гораздо меньше, чем в жидкости, т. к. в твердом теле каждой молекуле доступна только малая область пространства между соседними узлами кристаллической решетки, а в жидкости молекулы занимают всю область пространства. Поэтому при равной температуре энтропия твердого тела меньше энтропии жидкости. Это означает, что твердое тело представляет собой более упорядоченную и менее хаотичную систему, чем жидкость. Фазовый переход «жидкость–газ»Закон испарения и конденсации можно записать в общем виде: ��=±���δQ=±rdm где знак плюс относится к испарению, а знак минус – к конденсации: Δ�=±��/�к(1)ΔS=±λm/Tк(1) Из формулы (1) следует, что при испарении энтропия возрастает, а при конденсации – уменьшается. Физический смысл этого результата состоит в различии фазовой области молекулы в жидкости и газе. Хотя в жидкости и газе каждой молекуле доступна вся область пространства, занятая системой, но сама эта область для жидкости существенно меньше, чем для газа. В жидкости силы притяжения между молекулами удерживают их на определенном расстоянии друг от друга. Поэтому каждая молекула хотя и имеет возможность свободно мигрировать по области пространства, занятой жидкостью, но не имеет возможности «оторваться от коллектива» остальных молекул – стоит ей оторваться от одной молекулы, как тут же притягивается другая. Поэтому объем жидкости зависит от ее количества и никак не связан с объемом сосуда. Молекулы газа ведут себя иначе: у них гораздо больше свободы. Среднее расстояние между ними таково, что силы притяжения очень малы и молекулы «замечают друг друга» лишь при столкновениях. В результате газ всегда занимает весь объем сосуда. Поэтому при равных температурах фазовая область молекул газа значительно больше фазовой области молекул жидкости и энтропия газа больше энтропии жидкости. Газ, по сравнению с жидкостью, гораздо менее упорядоченная, более хаотичная система. | |
| Просмотров: 150 | |