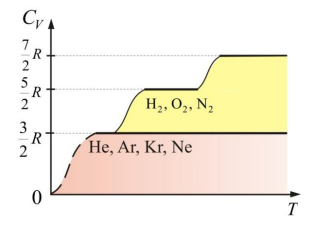
Теплоемкость одноатомных и многоатомных газовИсходя из определения внутренней энергии для теплоемкости одноатомных газов, можно записать: ��=����=32�=12,5кДжкмоль⋅КCV=dtdU=23R=12,5кмоль⋅КкДж Из этого выражения видно, что (при постоянном объеме) теплоемкость ��CV – величина постоянная, от температуры не зависит. Теплоемкость при постоянном давлении для одноатомных газов: ��=52�=20,8кДжкмоль⋅КCP=25R=20,8кмоль⋅КкДж Полезно знать соотношение ����=�CVCP=γ,где γ — показатель адиабаты, �=20,812,5=1,67γ=12,520,8=1,67 Кроме того, �=�+2�γ=ii+2, тогда ��=�2�CV=2iR и ��=�+2��CP=ii+2R Используя показатель адиабаты γ, можно записать:��=��−1CV=γ−1R, тогда внутреннюю энергию можно найти по формулам: �=�����=����−1�или�=���−1U=μmCVT=μmγ−1RTилиU=γ−1PV Теоретический расчет теплоемкости для двухатомных газов (i = 5): ��=52�=20,8Джмоль⋅КCV=25R=20,8моль⋅КДж��=72�=29,1Джмоль⋅КCP=27R=29,1моль⋅КДж�=1,4γ=1,4 Многоатомные газы (i = 6): ��=4�=33,24Джкмоль⋅КCV=4R=33,24кмоль⋅КДж��=3�=24,93Джмоль⋅КCP=3R=24,93моль⋅КДж�=1,33γ=1,33 Далее, с ростом температуры теплоемкость быстро возрастает (явление «размораживания» степеней свободы молекулы) до классического значения ��=52�CV=25R, характерного для двухатомной молекулы с жесткой связью, в которой нет колебательных степеней свободы. При температурах свыше 2000 К теплоемкость обнаруживает новый скачок до значения 7R/2. Этот результат свидетельствует о появлении еще и колебательных степеней свободы. Все это объясняется специфическими квантовыми эффектами, необъяснимыми с позиции классической физики.
Рисунок 1. Экспериментальная зависимость молярной теплоемкости газов от температуры | |
| Просмотров: 195 | |